はじめに
こんにちは、東京院の院長、山﨑です。慢性的な腰痛に悩む患者さんにとって、「痛み」は身体だけでなく脳とも深く関係しています。実は脳には痛みを和らげる「下行性疼痛抑制系」 と呼ばれる仕組みが備わっており、このシステムがうまく働かないと痛みが長引くことがあります。
今回は、脳が痛みをコントロールするメカニズムである下行性疼痛抑制系の基本と、関連する治療についてわかりやすく解説します。
今回は非常に長い記事となりますが、専門用語もできるだけかみ砕いて説明しますので、腰痛改善のヒントにしてください。
目次
下行性疼痛抑制系とは?(脳と痛みの関係)
私たちがケガをしたり腰を痛めたりすると、その痛みの信号(侵害刺激)は神経を通って脳に伝わり、脳で「痛い」と感じます(これを上行性疼痛伝達系といいます) (二階堂琢也, 2022)。一方で私たちの体には、脳から脊髄に向かって痛みを和らげる信号を送る仕組みも備わっています。これが「下行性疼痛抑制系」と呼ばれるものです 。簡単にいえば、脳内の痛み制御システムで、脳が自ら“痛みのブレーキ”をかける回路なのです。
例えば、スポーツ選手が試合中は怪我の痛みを感じないのに、試合後に痛み出すことがあります。また戦場の兵士が重傷でも痛みをあまり感じなかったという報告もあります 。これは興奮や集中といった強い感情が痛みを一時的に遮断した結果であり、脳が下行性疼痛抑制系をフル活用して痛みを抑えていると考えられます 。つまり痛みは単に患部から自動的に伝わるものではなく、脳が積極的に調節しているということです。
下行性疼痛抑制系の主な構造(脳~脊髄)
では、この「痛みを抑える下行性システム」は体のどの部分で構成されているのでしょうか。主な構造を順に見ていきます。
前帯状皮質(ぜんたいじょうひしつ、ACC)
大脳の一部で、痛みの感情的な側面を処理する部位です。痛みやストレスを感じるとACCが活動し、脳の下行性抑制システムを起動するスイッチの役割を果たします。ACCなどの高次中枢からの信号が中脳へ伝わり、痛みを抑える指令がスタートします
中脳水道周囲灰白質(ちゅうのうすいどうしゅういかいはくしつ、PAG)
中脳にある灰色質で、下行性疼痛抑制の要(かなめ)となる中枢です。PAGは大脳辺縁系(ACC、扁桃体、視床下部など感情や本能を司る領域)から入力を受け取り、脳幹へ痛み抑制信号を送ります 。PAGを電気刺激すると痛みが和らぐ現象が知られており、この部位が強力な鎮痛作用の起点です 。PAGからは下行性の神経経路が延髄に向かって伸びています(小山純正, 2016)。
延髄縫線核(えんずいほうせんかく)
脳幹(延髄)にある縫線核と呼ばれる神経核の集まりで、PAGからの指令を受けて脊髄へ信号を送ります。特に大縫線核(延髄正中部の核)はPAGからの下行性入力で活性化し、セロトニン作動性ニューロンを脊髄後角まで投射します 。延髄縫線核は**セロトニン(5-HT)**という神経伝達物質を放出することで、脊髄で痛み伝導を抑制する役割を担っています。
青斑核(せいはんかく)
脳幹(橋の部位)にある青斑核も下行性疼痛抑制に重要な構造です。青斑核のニューロンは**ノルアドレナリン(NA)**を放出しながら脊髄後角に投射し、痛み信号を抑制します 。セロトニン系と並んで、ノルアドレナリン系の下行経路がもう一つの痛み抑制ルートとなっています。
脊髄後角(せきずいこうかく)
脊髄の後部にある灰白質で、末梢神経からの痛み信号が最初に中枢に取り込まれる場所です。後角には一次ニューロン(末梢からの侵害信号を伝える神経)と二次ニューロン(脊髄から脳に情報を上げる神経)のシナプスがあります。先述の延髄縫線核からのセロトニン神経や青斑核からのノルアドレナリン神経は、この脊髄後角に終止しており、ここで痛みの信号を抑え込む作用を発揮します 。具体的には、脊髄後角で放出されたセロトニンやノルアドレナリンが抑制性の介在ニューロン(痛み伝達を妨げる神経)を活性化したり、痛みの一次ニューロンから二次ニューロンへの信号伝達を妨害したりします。
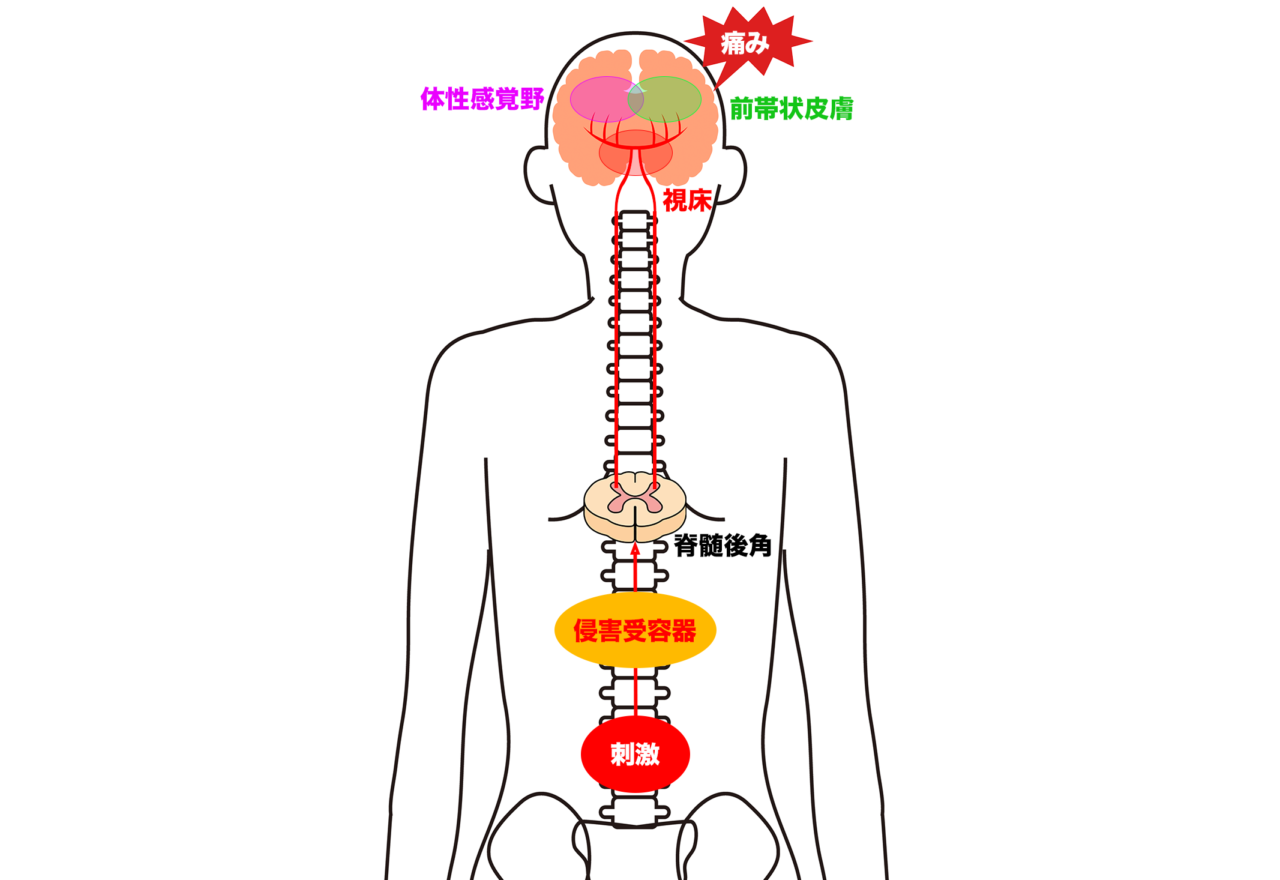
大脳辺縁系(前帯状皮質、扁桃体、視床下部など)や前頭前野からの入力を受けた中脳PAGが起点となり、**脳幹RVM(吻側延髄腹内側部:延髄縫線核などを含む)**を経由して脊髄後角に至る下降性の痛み抑制経路を示す模式図です。赤い矢印が脳から下行する抑制性経路(痛みを抑える信号)、緑の矢印が上行する侵害信号(痛み刺激)を表しています。このネットワークにより、脳が脊髄レベルで痛みの感じ方を調節します。
痛みを抑えるメカニズム:神経伝達物質と回路
下行性疼痛抑制系では、脳からの信号がどのように痛みを抑え込むかがポイントです。キーワードは神経伝達物質と神経回路、そして神経の可塑性です。
まず神経伝達物質ですが、先に述べたように中心的な役割を果たすのがセロトニン(5-HT)とノルアドレナリン(NA)です。これらは脳内のモノアミンと呼ばれる物質で、普段は心の状態(気分や緊張)にも関与していますが、痛みの抑制にも使われます 。脊髄後角でセロトニンやノルアドレナリンが放出されると、いくつかの作用で痛み信号が抑えられます。
(1)抑制性介在ニューロンの活性化: セロトニンやNAは脊髄内の痛みを抑える介在神経を活性化し、痛み伝達ニューロンに対して抑制的に働かせます。
(2)シナプス前抑制: ノルアドレナリンは一次感覚ニューロン(痛み信号を運ぶ神経)の末端に作用して、痛み物質(グルタミン酸など)の放出を減らします。これにより二次ニューロンへの入力そのものを弱めてしまいます。
(3)直接抑制: セロトニンは二次ニューロン自体にも作用し、その興奮(発火)を抑える受容体があります 。これら複合的な作用で、脳からの下行性信号は脊髄で痛みの「ボリューム」を下げているのです。
さらに見逃せないのが内因性オピオイドの存在です。オピオイドとはモルヒネ様の鎮痛物質で、体内でもβエンドルフィンやエンケファリン、ダイノルフィンといった物質が作られています。強い痛みやストレス時にはこれら内因性オピオイドが放出され、脳や脊髄で鎮痛効果を発揮します。特に脳内の視床下部や脳幹から出るβエンドルフィンやエンケファリンは、PAG内部の抑制性介在ニューロン(GABA作動性ニューロン)を抑制します 。普段、PAGの出力ニューロンはGABAニューロンによってブレーキがかけられていますが、オピオイドが放出されるとそのブレーキが外れ、PAGの痛み抑制ニューロンが一気に活動します 。これを**抑制の抑制(disinhibition)**と呼び、結果として下行性抑制系がオンになり強力な鎮痛が生じます 。脊髄レベルでも、エンケファリン作動性の介在ニューロンが一次ニューロンからの痛み物質放出を抑えるなど、オピオイド系は多層的に痛みを弱めます。
以上のように、生体は脳内モルヒネ(オピオイド)やモノアミン(セロトニン・ノルアドレナリン)を駆使して、痛み信号にブレーキをかけています。この神経回路は状況に応じて可塑的に変化します。神経の可塑性とは、神経回路が経験によって強まったり弱まったりする性質のことです。例えば、急性の痛み刺激が加わると一時的に下行性抑制系が活性化して痛みを和らげますが、痛み刺激が繰り返され慢性化すると神経回路に変調をきたすことがあります 。何度も痛み信号が脳に入力されると、脳や脊髄の神経が過敏になり(中枢性感作)、刺激がなくなった後も過敏状態が続いてしまうのです 。さらに、後述するように心理的ストレスによっても脳内の痛み抑制システムは影響を受けます 。このように、下行性疼痛抑制系は神経化学物質の作用と神経回路の学習的変化によって、その働きが強まったり弱まったりします。
薬物療法: SNRI(抗うつ薬)で下行性抑制系を強化
痛みを薬で和らげるというと、鎮痛剤(消炎鎮痛薬やオピオイドなど)を思い浮かべるかもしれません。ところが慢性の痛みでは、脳の下行性疼痛抑制系を強化するタイプの薬が有効な場合があります。その代表が抗うつ薬の一種である SNRI(セロトニン・ノルアドレナリン再取り込み阻害薬)です。

SNRIは文字通りセロトニンとノルアドレナリンが神経細胞に再吸収されるのを阻害する薬で、これら神経伝達物質の濃度を高める作用があります。もともとはうつ病の薬として開発されましたが、脳内モノアミンを増やすことで痛みの抑制経路を賦活(ふかつ)する効果があることがわかりました 。簡単に言えば、下行性疼痛抑制系のブレーキ役物質(5-HT, NA)を増やすことで、脳の痛み抑制ネットワークを後押しするのです。
具体的に、SNRIを内服すると脳幹の縫線核や青斑核から出るセロトニン・ノルアドレナリン神経の働きが高まります 。その結果、脊髄で痛み伝達を抑える信号が強まり、痛みの感じ方が弱まります。興味深いことに、うつ病などで脳内のセロトニンやNAが減少していると、この下行性抑制系もうまく働かなくなり痛みが増幅される傾向があります 。つまり心の不調で脳内のモノアミンが不足すると痛みを抑える力も低下してしまうのです 。このことからも、抗うつ薬でセロトニンやNAを増やすことが慢性疼痛の治療に有用である理由が理解できます。
なお、抗うつ薬にはSSRI(選択的セロトニン再取り込み阻害薬)や三環系抗うつ薬(TCA)などもありますが、痛みの治療にはセロトニンだけでなくノルアドレナリンも増やせるSNRIが特に有効とされています 。ノルアドレナリン作動系は痛み抑制に欠かせない経路の一つであり、SNRIはその点で理にかなった薬といえます。実際、古くから慢性疼痛に三環系抗うつ薬(アミトリプチリンなど)が使われてきましたが、副作用の点で最新のSNRI(デュロキセチンやミルナシプラン等)の方が使いやすく、現在はこちらが主流になりつつあります。
慢性腰痛では下行性抑制系がうまく働かない
**慢性腰痛(3ヶ月以上続く腰痛)になる背景には、下行性疼痛抑制系の働きの低下**が関与していると考えられます 。本来であれば、ケガなどによる急性の痛みは時間とともに治まり、痛み回路も元の状態に戻るはずです。しかし慢性腰痛症では、痛み刺激が長期間続くことで神経系が過敏化し、脳から痛みを抑える信号が十分に出なくなっている可能性があります。いわば**「痛みのブレーキが故障した状態」**であり、その結果として痛みが必要以上に長引いてしまうのです。

慢性腰痛患者さんでは、画像検査で明らかな異常がないのに痛みが強い場合や、通常なら治っているはずの時期を過ぎても痛みが続く場合があります。これは、脳や脊髄の痛み調節ネットワークがうまく働かず、痛みのスイッチが切れっぱなしになっている状態とも言えます。
また、心理的・感情的な要因も下行性疼痛抑制系の働きに大きく影響します。慢性的な痛みに苦しんでいると気分が落ち込みやすくなりますが、抑うつ状態や不安があると脳内でセロトニンやノルアドレナリン、ドーパミンといった物質の放出が低下し、結果的に痛みを抑える力が弱まります 。実際、慢性痛患者では抑うつ傾向を合併する人が多いことが知られています。痛みで活動できず社会的にも孤立しがちになるとさらに気分が沈み…という悪循環に陥るケースもあります 。このように慢性腰痛と心理状態は相互に影響し合い、脳の痛み抑制システムを介して痛みの感じ方を変化させるのです。
一方で、前向きな心理状態や適度な運動は下行性抑制系を強化することがわかっています。例えば楽しい予定があるときや夢中になれることをしているときには痛みを感じにくくなる傾向があります 。この現象は脳内でドーパミンなど報酬系の物質が増え、下行性抑制系を活発にするためと考えられます 。慢性腰痛の治療では、痛みそのものへのアプローチと同時にメンタルケアや生活リズムの改善が重視されるのはそのためです。
慢性腰痛に使われる薬: デュロキセチンとミルナシプラン
下行性疼痛抑制系を改善する治療薬として、現在効果が実証されている代表的な薬がSNRIのデュロキセチンとミルナシプランです。
デュロキセチン(商品名:サインバルタ)
デュロキセチンはSNRIの一種で、もともと抗うつ薬として開発されましたが、糖尿病性神経障害痛や線維筋痛症、変形性関節症の疼痛など幅広い慢性痛への有効性が確認されています 。日本でも2016年に「慢性腰痛症に伴う疼痛」への適応が承認され、現在は慢性腰痛の治療薬として保険適用で使用されています 。複数の臨床試験で腰痛の痛みスコアを有意に改善し、生活の質(QOL)や身体機能も向上させることが示されています (Konno et al., 2016)。例えば日本人慢性腰痛患者を対象とした14週間のプラセボ対照試験では、デュロキセチン60mg投与群はプラセボ群に比べ痛みが有意に減少し、症状の改善を患者自身が実感する割合も高くなりました 。その安全性プロファイルも比較的良好で、主な副作用は眠気、便秘、吐き気、めまい、口の渇きなどであり、多くは軽度~中等度で経過とともに改善しています 。現在、国内外のガイドラインでデュロキセチンは慢性腰痛や慢性筋骨格系疼痛に対する有効な選択肢として位置付けられており、特に従来の鎮痛薬で効果不十分なケースや、神経痛的な要素を伴う腰痛に推奨されています。
ミルナシプラン(商品名:トレドミン)
ミルナシプランもSNRIに分類される薬で、日本ではうつ病の治療薬として使われてきました。海外では線維筋痛症(Fibromyalgia)という慢性痛症候群の治療薬として承認されており、慢性疼痛に対する有効性が研究されています 。線維筋痛症は全身の慢性痛を特徴とする疾患ですが、ミルナシプランはその痛みとQOLを改善する効果がある程度認められています 。例えばコクランレビュー(研究結果を総合評価するレビュー)では、ミルナシプラン100~200mgの投与で約40%の線維筋痛症患者に痛みの中等度軽減(30%以上の疼痛緩和)が得られたと報告されています(プラセボでは30%に緩和)(Derry et al., 2012) 。ただし効果が十分現れるのは一部の患者に限られ、副作用(悪心や便秘など)の発現も多いため、効果と副作用のバランスを見極めながら使う必要があるとも指摘されています 。慢性腰痛そのものへのミルナシプランのエビデンスはデュロキセチンほど多くありませんが、同じ機序を持つ薬として他の慢性痛にも応用可能性があります。実際、三環系抗うつ薬で痛みが緩和しなかった患者でミルナシプランに切り替え有効だった例なども報告されています 。現在日本の慢性痛診療ではデュロキセチンが第一選択となる場面が多いですが、ミルナシプランも患者さんの状態によっては選択肢に入るでしょう。
患者さんにとってのメリットと治療選択のポイント
下行性疼痛抑制系の知識は、慢性腰痛に悩む患者さんにとっていくつかの示唆を与えてくれます。
まず、痛みが長引く原因の一つに「痛みを抑える脳のブレーキが利きにくくなっている」可能性があると理解できれば、**「痛み=身体の酷使や炎症だけが原因ではない」**ことがわかります。実際、腰痛はレントゲンやMRIで異常が見つからないケースも多く、そうした痛みには中枢神経系の機能変化が関与していると考えられます 。これは決して「痛みは気のせい」と言っているのではありません。痛みには確かな生物学的メカニズムがあり、それが身体だけでなく脳にもあるということです。脳の痛み抑制力が落ちているなら、それを回復・補強してあげることが治療戦略になります。
デュロキセチンやミルナシプランといったSNRI系の薬は、まさに脳内の痛み抑制ネットワークをテコ入れする治療です。鎮痛補助薬とも位置づけられ、従来の消炎鎮痛薬(NSAIDs)や神経ブロック、理学療法などで十分な効果が得られない慢性腰痛に対して、痛みの感じ方自体を和らげる目的で処方されることがあります 。患者さんからすると「抗うつ薬を痛みに使うなんておかしいのでは?」と思うかもしれません。しかし上記のような脳内メカニズムから、抗うつ薬=脳の痛み止めとして働くことが明らかになっているのです。実際にこれらの薬は抑うつ症状がない痛み患者さんにも有効であることが臨床研究で示されています 。痛みが軽減すれば活動性が上がり、気分も前向きになるというプラスの連鎖も期待できます。
患者さんにとってのメリットは、痛みの軽減だけでなく睡眠や気分の改善、副次的に生活の質向上にもつながりやすい点です 。慢性腰痛では痛みのせいで夜間よく眠れなかったり、趣味や仕事に支障が出たりしますが、SNRIの服用で痛みが和らぐと「少し体を動かしてみよう」「もう一度趣味を楽しんでみよう」という気持ちになれることもあります。そのようなポジティブな行動がさらに脳の痛み抑制系を強め、症状改善に拍車をかけるでしょう。
もっとも、SNRIは即効性の鎮痛薬ではなく、効果発現に2~4週間程度かかることもある点には注意が必要です。いわば痛みの「底上げ」を図る薬であり、じっくり神経系に作用していきます。また全員に効果があるわけではなく、副作用で継続が難しい場合もあります。主治医と相談しながら、効果と副作用のバランスを見つつ治療方針を決めていくことが大切です 。薬物療法だけでなく、運動療法や認知行動療法(痛みに対する考え方を前向きにする心理療法)などを組み合わせると相乗効果が得られます 。痛みの感じ方は脳で変えられる――この事実は、腰痛と付き合う上で希望にもなります。適切な治療薬の助けを借りながら、生活リズムの改善やストレス軽減にも取り組むことで、脳の「痛みブレーキ」を取り戻していきましょう。

この記事のまとめ
今回の内容は少し専門的なお話になりましたので簡単にまとめたいと思います。
- 慢性的な腰痛は、単なる体の問題ではありません。
私たちの脳には、痛みを和らげる「下行性疼痛抑制系」という素晴らしい機能が備わっています。しかし、慢性的な腰痛に悩む方は、この「脳の痛み止めシステム」がうまく働かなくなっている可能性があります。
- 痛みの原因は「心のせい」ではなく、「脳の機能」のせいかも。
心の状態(ストレスや不安)が、脳の痛み抑制システムを弱めてしまうこともあります。だからこそ、慢性腰痛の治療には「心」と「脳」へのアプローチが重要です。
- 薬で痛みの「ブレーキ」を修理できる時代へ。
デュロキセチンやミルナシプランといったSNRI(抗うつ薬)は、脳内のセロトニンやノルアドレナリンを増やし、痛み抑制ネットワークを活性化します。これにより、従来の鎮痛剤では効果がなかった痛みにも効果が期待できます。
- 「痛みは気のせい」ではありません。
痛みを長引かせているのは、脳の機能的な変化です。この変化を理解し、適切な治療法(薬物療法、運動療法、心理療法など)を組み合わせることで、腰痛の悪循環を断ち切り、より快適な生活を取り戻すことができるのではないでしょうか。
参照文献(原著論文・ガイドライン)
Derry, S., Gill, D., Phillips, T., & Moore, R. A. (2012). Milnacipran for neuropathic pain and fibromyalgia in adults. Cochrane Database Syst Rev, 3(3), Cd008244.
Konno, S., Oda, N., Ochiai, T., & Alev, L. (2016). Randomized, Double-blind, Placebo-controlled Phase III Trial of Duloxetine Monotherapy in Japanese Patients With Chronic Low Back Pain. Spine (Phila Pa 1976), 41(22), 1709–1717.
Lancon, K., & Seguela, P. (2023). Dysregulated neuromodulation in the anterior cingulate cortex in chronic pain. Front Pharmacol, 14, 1289218.
Mallows, A. Pain Descending Pathways. Physiopedia.
小山純正. (2016).水道周囲灰白質 (Periaqueductul gray).脳科学辞典.
二階堂琢也. (2022).慢性疼痛のメカニズムを理解する.ファーマスタイルWEB.
この記事の著者

東京院 院長山﨑 文平
2006年:川﨑医科大学卒業・医師免許取得・大阪警察病院勤務、2007年:大阪大学医学部付属病院勤務、2009年:大阪府立急性期・総合医療センター勤務、2011年:大阪大学医学部付属病院勤務、2013年:国立成育医療研究センター勤務、2015年:社会医療法人財団石心会川﨑幸病院勤務、2022年:慶応義塾大学医学部HTA公的分析研究室特任研究員、2023年:野中腰痛クリニック勤務・研修を経てライセンス獲得